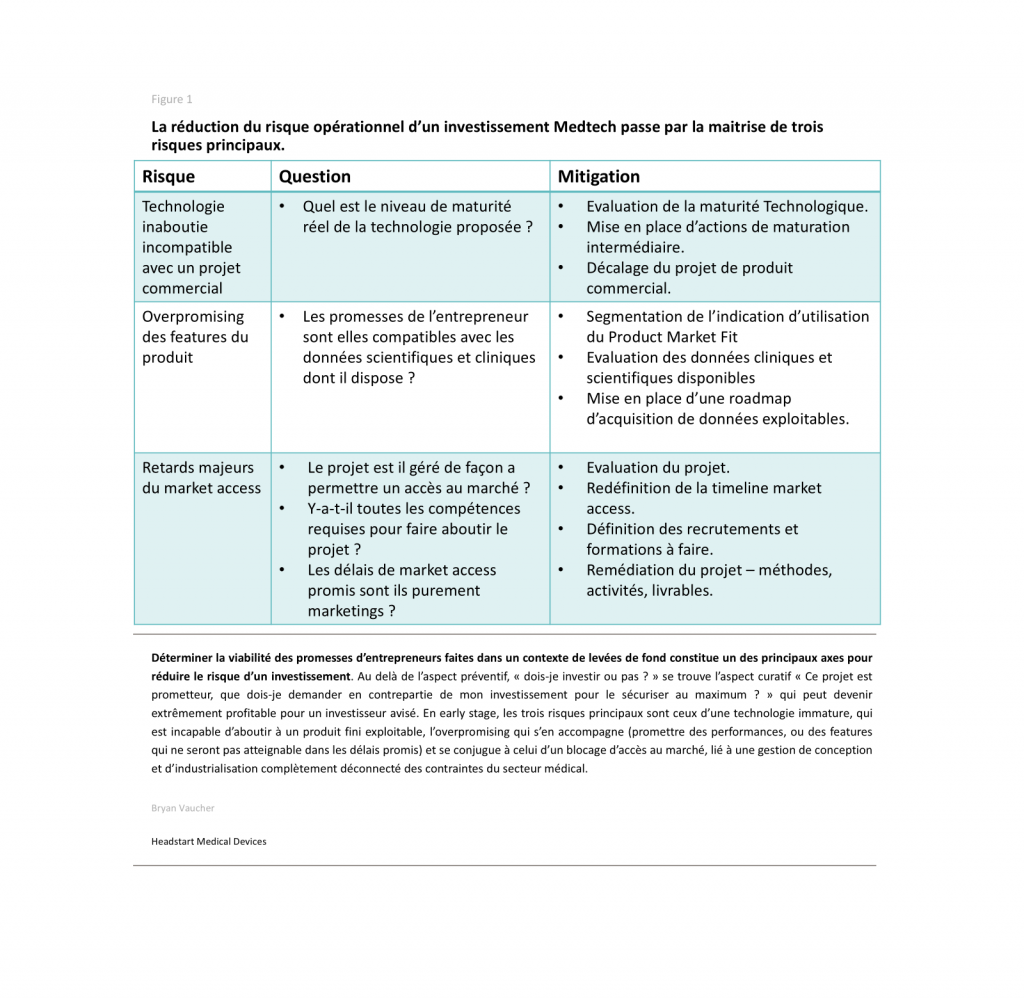
Chez Headstart Medical Devices, nous accompagnons régulièrement des actionnaires et investisseurs primo-entrants dans le monde des startups Medtech. Ces derniers maitrisent parfaitement les aspects généralistes, mais disposent d’angles morts au niveau des aptitudes et pratiques qu’une tel entreprise doit avoir pour tenir ses promesses de rentabilités. Le but de cet article est de vous présenter les 3 signaux de faiblesse récurrents qui doivent alerter un actionnaire, et surtout des solutions concrètes pour réduire le risque d’échec.
Risque n°1 : Précipiter une technologie medtech immature vers un produit de série
Dans l’enthousiasme des débuts, les entrepreneurs ont parfois tendance à brûler les étapes : ils passent trop rapidement d’un dispositif pilote validé en laboratoire à un produit industriel commercialisable, sans s’assurer que les performances observées en conditions contrôlées sont réellement reproductibles en usage clinique.
On part alors d’une technologie encore immature, qui fonctionne très bien sur de petits échantillons ou dans des environnements simulés, et l’on tente de la transposer brutalement à l’échelle industrielle, en supposant que les performances seront parfaitement réplicables. Or, cette hypothèse néglige toute une phase intermédiaire pourtant critique : les tests à des niveaux progressivement scalables, réalisés dans des environnements de plus en plus proches des conditions réelles d’utilisation, jusqu’à atteindre si pertinent le gold standard : la démonstration de performance du produit en environnement clinique.
Le premier risque est donc simple, mais majeur : la technologie n’est pas suffisamment mature.
Pour objectiver ce point, je m’appuie en routine sur le Technology Readiness Level (TRL), une échelle initialement développée par la NASA, puis déclinée et adaptée par de nombreux secteurs, dont les medtechs.
Le TRL permet de situer précisément un projet sur l’axe allant de la preuve de concept à un produit pleinement opérationnel.
Pour faire simple, un produit qui n’a pas démontré ses performances sur des indications aussi proches du réel que possible , sans nécessairement parler de tests sur patients, mais bien d’un usage conforme à son indication finale (par exemple, un dispositif de diagnostic utilisé exactement dans son cadre d’application prévu) présente un risque très élevé pour le projet.
Ce risque est relativement simple à détecter. Il suffit d’analyser en détail l’ensemble des données de tests produites par l’équipe, puis de les comparer aux conditions d’usage réel du produit. Les écarts apparaissent souvent rapidement : données non transposables, hypothèses d’équivalence fragiles, ou justifications approximatives destinées à masquer des limites techniques non résolues.
Une attention particulière doit être portée au plan d’échantillonnage. Des résultats basés sur un ou deux points de données n’ont que très peu de valeur statistique et peuvent dissimuler une technologie bien moins robuste que ce que laissent entendre les performances annoncées.
Dans certains cas, ces biais suffisent à masquer un produit qui ne fonctionnera pas aussi bien qu’anticipé, une fois confronté à la réalité du terrain.
Si le sujet vous intéresse, je vous recommande cet excellent MOOC sur coursera qui vous donne des bases solides pour la compréhension des statistiques dans le médical.
La question centrale est alors la suivante : faut-il investir, ou non, dans un projet technologique dont la technologie n’est pas encore pleinement mature ?
La réponse dépend avant tout de votre appétence au risque.
Dès lors que l’on s’intéresse à des technologies immatures ou insuffisamment éprouvées en conditions réelles, on entre clairement dans une logique de capital-risque.
Si vous êtes à l’aise avec ce type d’investissement, en intégrant à la fois l’incertitude technologique, le potentiel de marché et les délais nécessaires pour aboutir à un produit viable, alors oui, cela peut être une opportunité pertinente.
Il existe toutefois un point de vigilance essentiel, sur lequel je souhaite insister. En tant qu’investisseur, il est crucial d’accompagner activement les entrepreneurs, qui ont souvent tendance à se précipiter entre une technologie validée en laboratoire et un produit commercialisable. À ce stade, il faut savoir imposer un temps d’arrêt.
Ce temps n’est pas perdu. Il est indispensable pour valider la technologie de manière progressive, sur des modèles de plus en plus complets et représentatifs de l’usage réel, avant toute transposition vers une production en série.
Le temps que l’on pense gagner en accélérant la mise sur le marché d’un produit insuffisamment validé est presque toujours reperdu lors des phases de reconception et de remédiation face aux échecs règlementaire.
Ce cycle infernal entraine des surconsommations majeures de capitaux, en plus de délais considérables, et dans le pire de cas cela peut offrir à des concurrents le temps nécessaire pour se positionner, déposer des brevets concurrents et, in fine, fragiliser durablement voire condamner le projet initial.
En tant qu’investisseur, il est donc fondamental que vous détectiez aussi tôt que possible la maturité de la technologie qui vous est proposée.
Dans ce type de situation à risque, une injection de capital présenté comme de la croissance ou de l’industrialisation, peut en fait être largement sous-dimensionné, et financer de facto les activités de R&D manquantes, de façon bancale et approximatives pour tenir les jalons, ce qui est bien plus contre-productif qu’une phase de R&D assumée et couverte par des levées de fonds dédiés, et un encadrement approprié à une telle phase.
La bonne nouvelle sur les technologies médicales immatures est que, au sein de l’union européenne, un mécanisme est en train d’être mis en place. le breakthrough Devices (BTX), similaire à celui des états-unis vise à faciliter le développement et la validation technologique pour les DM les plus innovants.
Son déploiement et sa généralisation se fait progressivement à partir de janvier 2026 pour finir courant 2028.
Il est donc particulièrement pertinent de recommander a ce type d’entreprise éligible de suivre ce processus et d’assumer la stratégie de levée de fonds, que de tenter de forcer une mise sur le marché avec un projet R&D bâclé (au sens gestion de projet et constitution de dossier technique).
Risque n°2 : Surévaluer les fonctionnalités du produit (over-promising)
Le second point de vigilance, qui découle très souvent du premier, concerne la tendance à surévaluer les fonctionnalités et les performances du produit. Dans le cadre des levées de fonds, cette pratique est fréquente, les entrepreneurs cherchent naturellement à rendre leur technologie, leur produit et leur entreprise aussi attractifs que possible.
Toutefois, si l’objectif est de réduire le risque associé à un investissement Medtech, il est essentiel de ne pas se laisser convaincre uniquement par un discours bien construit.
La question centrale à se poser est la suivante : les promesses formulées par l’entrepreneur sont-elles réellement compatibles avec les données scientifiques et cliniques disponibles à ce stade du projet ?
Il n’est pas nécessaire d’être expert scientifique pour identifier ce risque. En revanche, il est indispensable d’analyser avec attention la segmentation de l’indication d’utilisation. Les promesses excessivement larges constituent, dans la grande majorité des cas, un signal d’alerte.

À titre d’exemple, un fabricant affirmant être capable de diagnostiquer « tous les types de cancer » expose un positionnement difficilement crédible. À moins de disposer de jeux de données cliniques extrêmement vastes et couvrant l’ensemble des types et sous-types de cancers, ce qui, en pratique, n’existe pas. Ce type de promesse doit être considéré avec une grande prudence.
À l’inverse, un projet ciblant volontairement une indication restreinte, clairement définie, et appuyée par des données scientifiques et cliniques cohérentes, présente généralement un niveau de robustesse bien supérieur. Ce type de segmentation limite le risque de décalage entre les performances annoncées et les performances observées en conditions réelles d’utilisation.
Il est important de rappeler qu’une indication d’utilisation volontairement limitée ne constitue un avantage stratégique. Elle permet d’accélérer l’accès au marché et de concentrer les efforts réglementaires et cliniques sur un périmètre maîtrisé. Une fois le produit commercialisé, et à mesure que de nouvelles données de sécurité et de performance sont générées, l’entreprise pourra étendre progressivement ce périmètre, souvent plus rapidement que des concurrents ayant tenté d’adresser trop de cas d’usage dès le départ.
La segmentation ne doit d’ailleurs pas se limiter à la pathologie elle-même. Les populations de patients, les parcours de soins et les spécificités géographiques doivent également être intégrés dans l’analyse. Un projet qui vise d’emblée une couverture mondiale, sans tenir compte des variations épidémiologiques, cliniques ou réglementaires entre régions, présente un risque significatif d’overpromising.
Lorsque la technologie semble pertinente mais que le discours apparaît excessif il faut absolument challenger la stratégie clinique et produit, en incitant les entrepreneurs à travailler avec des experts médicaux et à recentrer leur proposition de valeur autour d’un produit minimum viable (MVP) clairement défini et atteignable dans le délai promis.
Risque N°3 : Un accès au marché repoussé continuellement, qui cache des déficiences
C’est le scenario sur lequel vous serez le plus fréquemment confronté en routine. Vous investissez dans un projet. On vous promet un marquage CE ou une autorisation de 510(k) sous 1 An. Vous patientez, puis au bout d’un an on vous annonce un report de 6mois à un An car la FDA/l’organisme notifié fait perdre du temps. Sauf que ça dure depuis 5 ans sur des reports de ce type.
Ne vous y trompez pas : la mise sur le marché d’un dispositif médical convenablement développé, industrialisé, avec des données de performances et de sécurité robustes et adéquate à son usage prévu ne sont pas coincés dans un processus règlementaire pendant des années. Les données dans l’union européenne sont sans appel. L’obtention d’un marquage CE prends entre 6 mois et 2 ans, ou elle n’aboutit en général jamais.
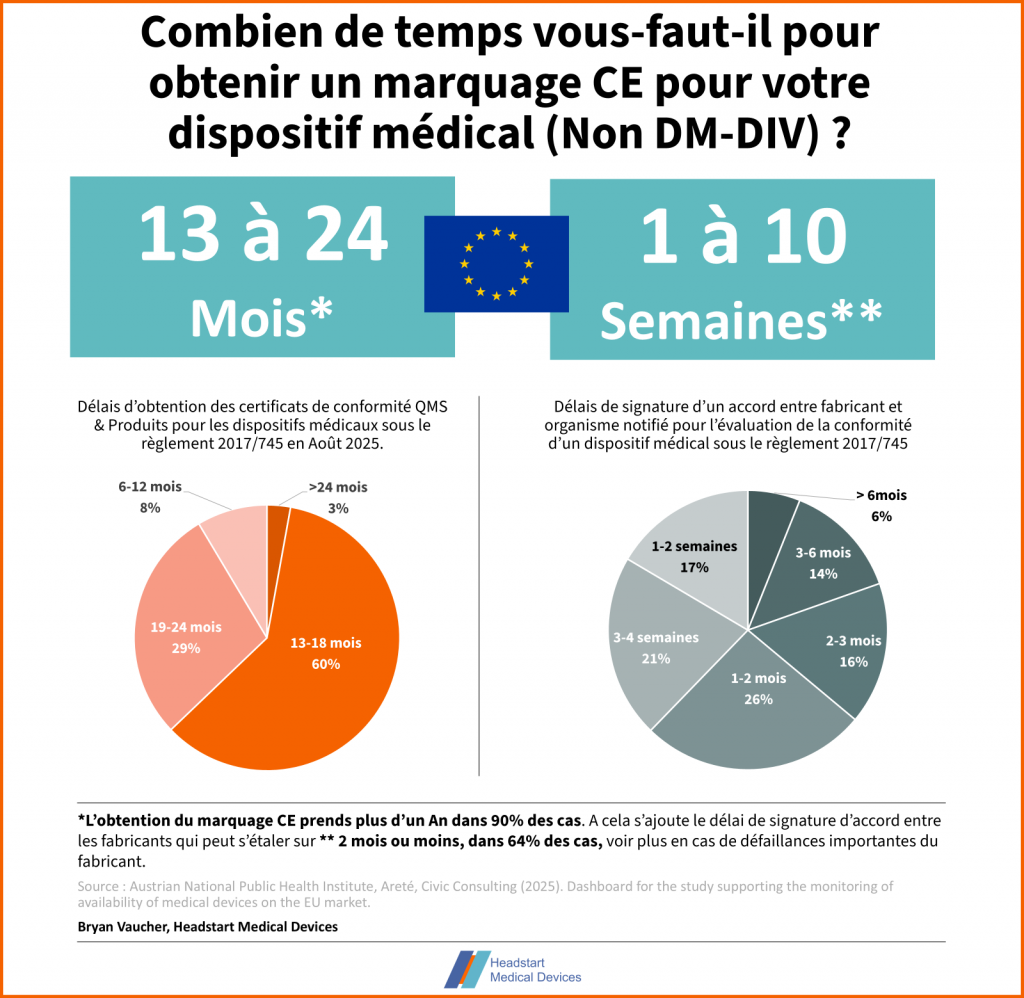
De la même façon, pour la FDA, l’agence a des objectifs des performances de 90 jours, jusqu’à 180 dans certains cas.
Vous aurez saisi l’idée : un processus règlementaire qui est repoussé de façon répétée dissimule vraisemblablement des dysfonctionnement interne important sur la conception et l’industrialisation du produit en question, mais aussi les risques N°1 et 2 que je mentionne au-dessus.
En routine, vous constaterez des problèmes similaires sur une grande majorité de vos investissements dans des starups Medtech. La raison est très simple : il s’agit de faiblesses dans le savoir faire requis pour la mise sur le marché d’un dispositif médical. Je ne parle pas du fait de savoir qu’il y a un processus règlementaire et des audits.
Le mot de la fin
J’ai rédigé cet article avec la conviction profonde que des actionnaires dotés d’une vision éclairée des réalités opérationnelles et des exigences du secteur médical peuvent transformer radicalement la réussite d’un projet.
Je constate malheureusement un schéma répétitif où overpromising devient la norme en Medtech. Pour séduire des investisseurs, certaines startups avancent des calendriers de mise sur le marché ou des features totalement déconnectés de la réalité.
Par conséquent, les investisseurs imposent naturellement leurs propres conditions en s’appuyant sur une perception biaisée de l’état d’avancement du projet.
Ce cercle vicieux pousse les entreprises à gaspiller un temps et un capital précieux pour courir après des objectifs inatteignables, ce qui compromet finalement le développement et la commercialisation du produit phare et donc la viabilité financière du projet.
S’il est tentant d’enjoliver la situation pour convaincre, cette pratique agit comme un véritable poison dans l’univers de la Medtech.
Toutefois, ce constat ne doit pas vous dissuader d’investir.
Bien au contraire, le fait de connaître ces risques vous donne le pouvoir de les confronter directement.
En exigeant une transparence totale, vous serez en mesure de définir des objectifs réalistes et des actions de remédiations qui garantiront la viabilité du projet et maximiseront, in fine, vos chances de retour sur investissement.
L’évaluation de projets de startups pour le compte de firmes de VC, de business angels et d’autres profils d’actionnaires constitue l’un des piliers fondamentaux de notre cabinet. Nous vous accompagnons pour déterminer la crédibilité technique, scientifique et opérationnelle d’un projet tout en vous aidant à formuler des conditions ainsi que des plans de remédiation concrets. Cette approche permet de garantir la réussite opérationnelle et de sécuriser au maximum vos investissements en Medtech.
Nous vous invitons à nous contacter pour un premier échange sans engagement.
Ce sera l’occasion d’aborder plus en détail les risques spécifiques et les solutions qui peuvent être mises en œuvre pour vous soutenir, vous et les entreprises que vous accompagnez.

