Avoir une vision claire du temps nécessaire pour qu’un produit MedTech obtienne le marquage CE dans l’Union européenne est un élément fondamental pour la définition d’un business plan.
Dans l’article d’aujourd’hui, nous verrons, selon les données actualisées d’août 2025, quels sont les délais auxquels vous pouvez vous attendre pour votre marquage CE.
L’ensemble des données exploités sur cet article peut être retrouvé sur la Dashboard Power BI Réalisée par la commission Européenne que vous pouvez retrouver ici
Sommaire
Une augmentation constante du nombre de dossiers traités par les organismes notifiés
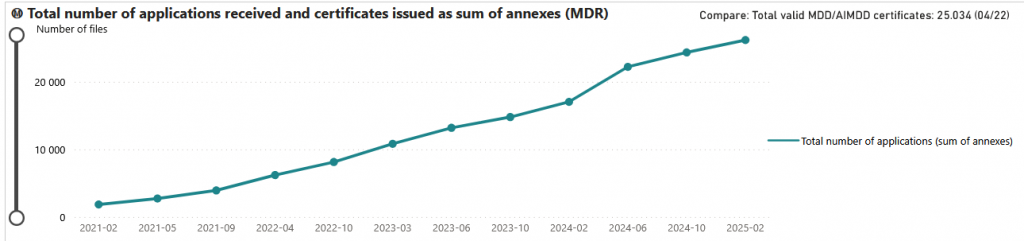
L’augmentation du nombre de dossiers techniques soumis aux organismes notifiés constitue l’une des principales causes de l’allongement des délais de certification.
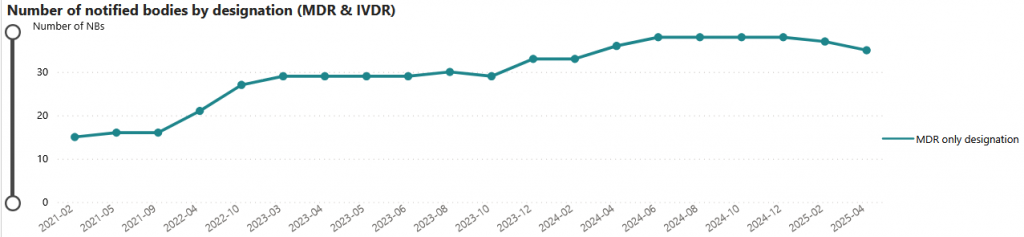
Le volume de dossiers en cours de traitement est passé de 10 000 au premier trimestre 2023 à 30 000 au deuxième trimestre 2025 (+66 %), tandis que le nombre d’organismes notifiés n’a augmenté que de 29 à 35 sur la même période (+18 %).
Cette tendance se reflète dans l’évolution des délais de certification, qu’il s’agisse du système qualité (QMS) ou de la documentation technique.
l’évolution des délais de certification en Europe
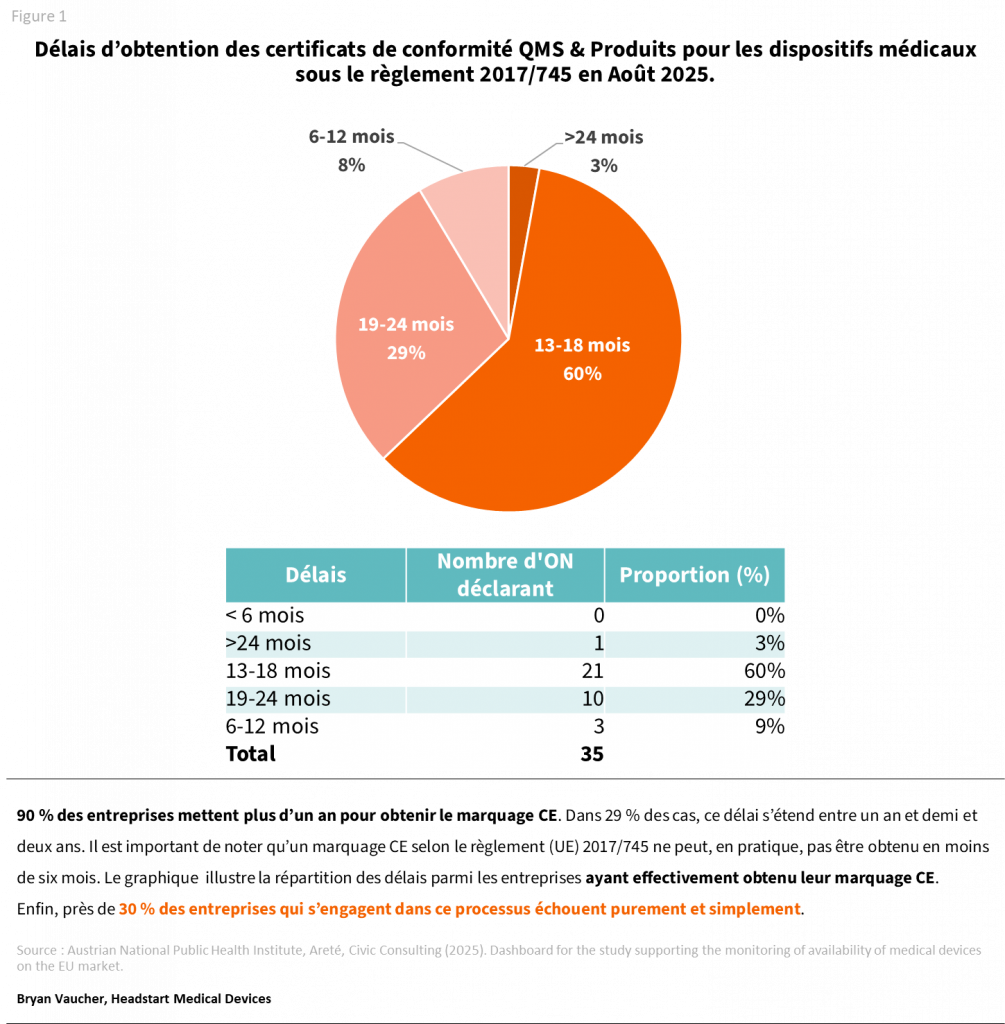
De manière générale, les délais de certification se situent majoritairement entre 13 et 24 mois, avec une concentration nette autour de 13 à 18 mois.
Les tendances observées au cours des deux dernières années montrent une dépolarisation des délais : il n’est plus possible d’obtenir une certification en moins de six mois, tandis que les processus inférieurs à douze mois ou supérieurs à vingt-quatre mois tendent à disparaître.
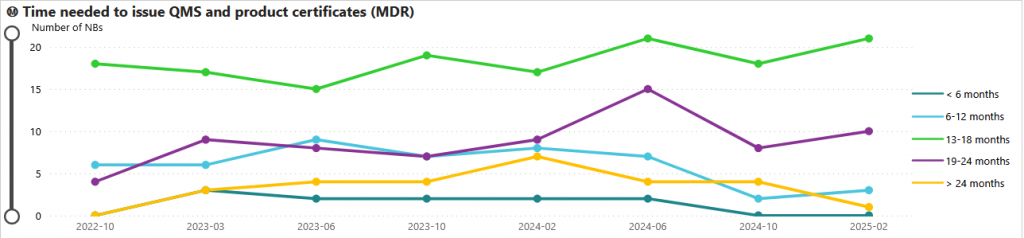
Au premier trimestre 2025, 90 % des fabricants étaient engagés dans un processus d’une durée supérieure à 12 mois.
Les dernières études introduisent une variable essentielle à prendre en compte : le taux de non-émission de certificats, c’est-à-dire la proportion de processus qui n’aboutissent pas.
Un taux d’échec élevé parmi les candidats au marquage CE
En 2025, les organismes notifiés rapportent que 30 % des processus échouent, malgré une acceptation initiale du dépôt du dossier.
Ces échecs résultent soit de l’épuisement de tous les cycles de revue, soit du retrait volontaire du fabricant.
Par ailleurs, 39 % des candidatures initiales sont refusées parce que le dossier technique est incomplet au moment du dépôt, et 20 % parce que le fabricant s’est trompé de procédure d’évaluation de la conformité ou de classification du dispositif.
Cela signifie que près de 60 % des rejets initiaux sont directement imputables au fabricant.
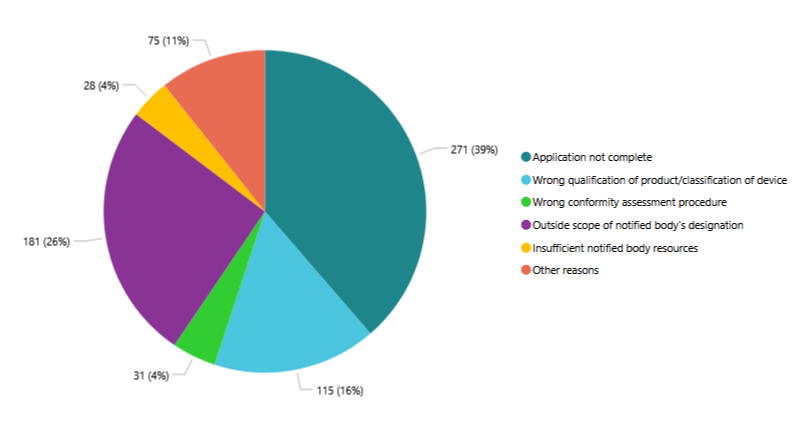
À ces constats s’ajoute une contrainte temporelle supplémentaire : avant même l’évaluation de la conformité, il faut compter un délai pour la revue de la candidature et la mise en place du contrat entre le fabricant et l’organisme notifié.
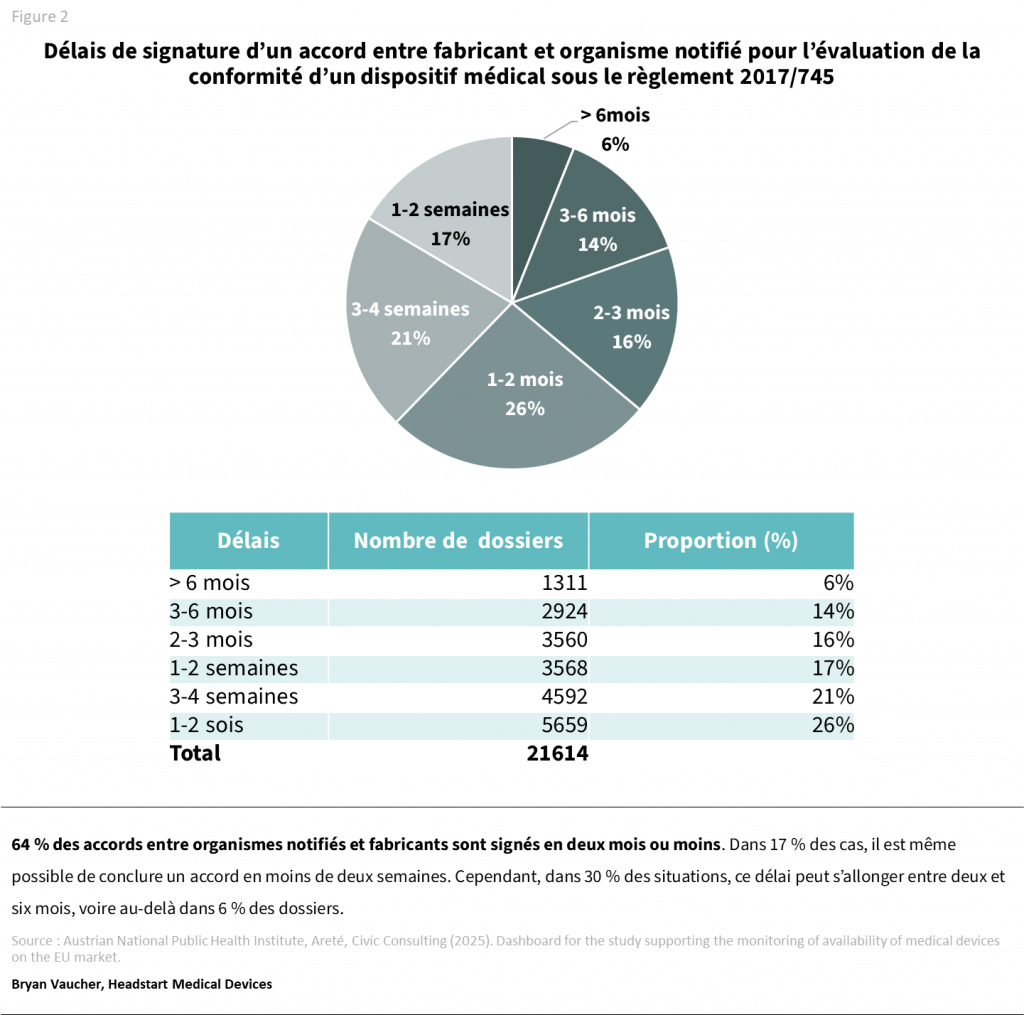
Attention aux délais contractuels
Ce délai varie, mais la majorité des accords sont conclus en trois semaines à deux mois (47 %), avec des durées pouvant dépasser deux mois dans 36 % des cas.
Cette variabilité semble principalement liée aux allers-retours administratifs entre le fabricant et l’organisme notifié, notamment lorsque la candidature n’est pas immédiatement rejetée, par exemple en cas de dossier volontairement déposé de manière incomplète pour accélérer la prise en charge initiale.
En conclusion
Se lancer dans un marquage CE sous le règlement (UE) 2017/745 est une démarche qui prend, dans la grande majorité des cas, plus d’un an. Ce délai concerne uniquement les projets qui aboutissent, car près de 30 % des fabricants sont écartés du processus avant son terme.
À ce temps d’évaluation s’ajoute une période de deux semaines à deux mois pour la contractualisation entre le fabricant et l’organisme notifié.
Cette phase peut s’allonger considérablement si le fabricant néglige la classification de son dispositif médical ou soumet un dossier technique incomplet, ce qui traduit le plus souvent une conception ou une industrialisation insuffisamment aboutie du produit.



Laisser un commentaire