Le modèle de la startup Tech, centré sur la vitesse et l’itération, se heurte aux réalités du secteur MedTech où la conformité, la traçabilité et la validation clinique conditionnent l’accès au marché. Transposer sans adaptation ces méthodes mène à des blocages, des coûts de remédiation élevés et une perte de crédibilité.
Réussir en MedTech suppose de traiter la conception et sa documentation comme un seul et même produit, de construire un calendrier financier réaliste et d’aligner investisseurs et équipes autour de KPI tangibles. Les dirigeants qui adoptent cette gouvernance maîtrisent le risque, accélèrent la valorisation et transforment une innovation en un dispositif médical industrialisable et compétitif dans des conditions temporelles et financières optimales.
Le modèle GSM pour expliquer les priorités d’une startup Tech.
L’article Software Development in Startup Companies: The Greenfield Startup Model analyse les pratiques de développement logiciel dans les startups, de l’idéation jusqu’à la première version bêta. À partir d’entretiens menés auprès de 13 fondateurs et CTO, les auteurs proposent le Greenfield Startup Model (GSM), un modèle explicatif des dynamiques propres aux startups.
Ces résultats montrent que les startups évoluent dans un environnement marqué par la rareté des ressources, l’incertitude et une pression temporelle intense. Leur stratégie centrale est d’accélérer le développement afin de livrer rapidement un produit utilisable, tester l’adéquation produit/marché et ajuster la trajectoire en fonction des retours utilisateurs.
Cette approche repose sur de petites équipes très impliquées et polyvalentes, travaillant avec des processus souples, une communication informelle et une faible production documentaire. La priorité est mise sur la rapidité et l’expérience utilisateur plutôt que sur la fiabilité, la robustesse ou les tests systématiques.
Ce choix permet de progresser vite mais au prix d’une accumulation de dette technique, due à l’absence d’architecture approfondie, à un faible recours aux tests automatisés et à une gestion de projet minimale.
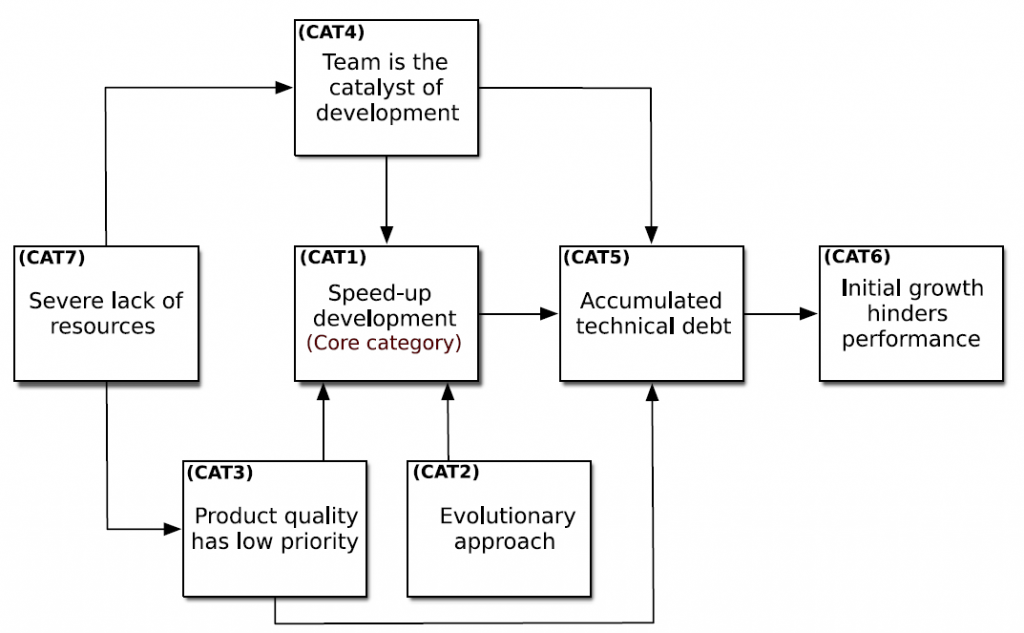
Ces compromis fonctionnent tant que la startup reste petite. La croissance en utilisateurs, fonctionnalités et effectifs en révèle vite les limites. La productivité chute et il devient nécessaire de restructurer le produit, de rembourser la dette technique et d’introduire des pratiques plus solides.
Comme vous pouvez le constater, ce modèle présente des forces mais aussi des faiblesses inhérentes aux startups tech.
À ces difficultés viennent s’ajouter des blocages et menaces fondamentales propres au secteur MedTech, qui démontrent sans ambiguïté que raisonner en startup Tech sans adaptation est une voie sans issue.
4 Raisons pour laquelle le modèle Tech n’est pas viable en Medtech
La figure 1 illustre une transcription et une adaptation du modèle GSM appliqué au contexte MedTech. Elle met en évidence les forces, faiblesses et menaces qui pèsent sur une startup issue du monde Tech lorsqu’elle aborde le développement d’un dispositif médical, ainsi que les conséquences directes pour l’organisation.

Plusieurs points de tension majeurs apparaissent et amplifient considérablement les difficultés pour une startup Tech qui se lance dans le médical.
- Négliger la qualité et la traçabilité pendant la conception bloque l’accès au marché. Les livrables projet, la traçabilité entre besoins, spécifications, conception et tests sont indissociables du produit. Sans eux, aucune mise sur le marché n’est possible. Plus le produit est complexe, plus les remédiations sont coûteuses et longues.
- L’approche évolutive de la conception doit être strictement maîtrisée. Toute modification significative d’un dispositif médical (hors classe I) nécessite une autorisation, voire un dépôt complet. Ces démarches s’accompagnent souvent de preuves cliniques supplémentaires. Il est donc crucial de viser juste dès la mise sur le marché initiale et de planifier soigneusement les évolutions.
- La dette technique accroît fortement le risque d’échec en vérification et validation. Une base instable génère des comportements imprévisibles, surtout après modification. Tout échec bloque l’accès au marché jusqu’à résolution et peut entraîner une cascade de retards de plusieurs mois.
- Même en cas d’accès au marché, un produit fragile entraîne une multiplication des signalements et incidents. Cela conduit à une surveillance renforcée des autorités (FDA, organismes notifiés), avec inspections répétées et risque de retrait du marché. La gestion de non-conformités dans des délais stricts mobilise fortement les ressources, dégrade la réputation du produit et freine son adoption clinique.
Quels sont les leviers que vous pouvez activer pour votre Startup ?
Au niveau de la relation avec les investisseurs et actionnaires
Un investisseur non spécialisé en MedTech raisonne d’abord en retour sur capital et en vitesse de valorisation.
Les contraintes réglementaires et industrielles du secteur ne sont pas spontanément intégrées à son analyse, ce qui impose au dirigeant de se positionner en gestionnaire de risque financier. Promettre une mise sur le marché rapide sans expérience réelle du cycle de développement crée des attentes intenables.
Elles se traduisent inévitablement par des blocages organisationnels, des retards et une perte de crédibilité.
À l’inverse, une relation de confiance durable repose sur des hypothèses réalistes, chiffrées et alignées avec les besoins du marché.
La première étape consiste à établir un calendrier financier crédible et à montrer clairement que des horizons trop courts dégradent la qualité, génèrent des surcoûts et retardent l’accès au marché.
Le vrai levier de création de valeur réside dans un développement maîtrisé, où chaque étape de conception et d’industrialisation est conduite avec rigueur. Les délais incompressibles doivent être assumés, et le dirigeant doit expliquer que les spécifications, analyses de risques et matrices de traçabilité sont partie intégrante du dispositif.
Les ignorer revient à compromettre la réussite du projet, et donc pour l’investisseur, à maximiser le risque de perte des capitaux qu’il a engagé.

Les études cliniques et les étapes réglementaires suivent la même logique : elles doivent être intégrées dans la planification dès l’origine, et financées à hauteur de leurs exigences.
Tant que les investisseurs n’ont pas validé les ressources nécessaires pour franchir ces jalons, toute discussion sur les délais réglementaires reste théorique.
Aucun produit non conforme n’entre sur le marché dans les temps, et toute tentative de contournement se traduit par un allongement significatif des délais.
En parallèle, la valorisation de l’entreprise avant mise sur le marché passe par la production régulière de preuves tangibles : résultats de tests techniques, études cliniques exploratoires, publications scientifiques ou comparatifs de performance par rapport aux standards du marché.
Ces éléments renforcent la crédibilité du produit, consolident les données de sécurité et de performance et soutiennent la traction auprès des investisseurs comme des futurs utilisateurs.
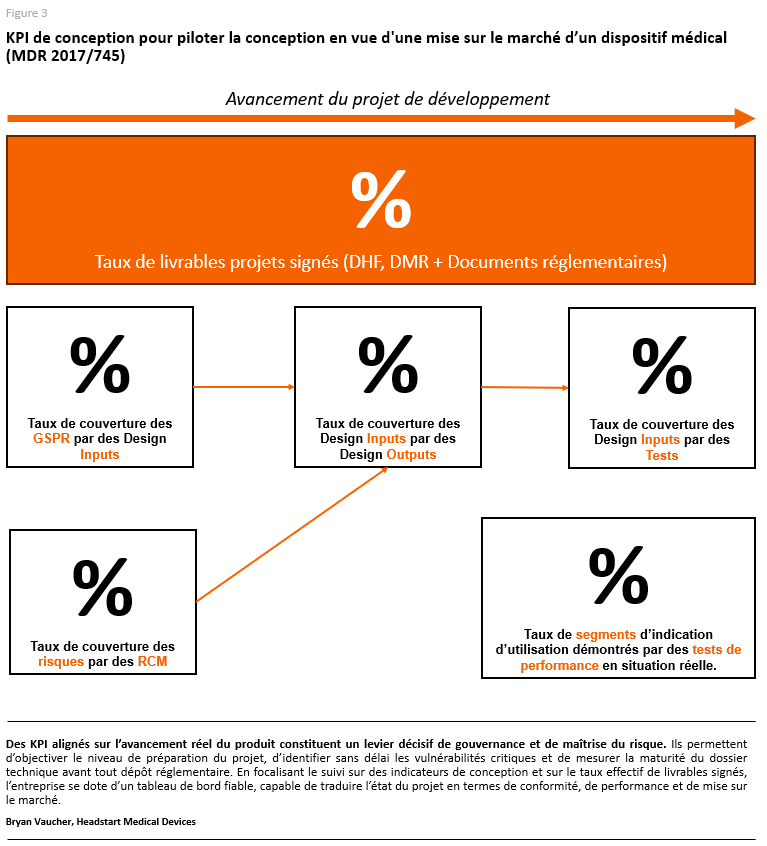
Enfin, le suivi du progrès doit être objectivé par des KPI alignés sur la conception.
Les livrables produits et leur état de complétion deviennent des indicateurs concrets de performance, traduisant l’avancement du projet dans un référentiel intelligible pour les investisseurs.
Ce mode de reporting permet de montrer que, même en attendant le dépôt réglementaire, l’investissement produit des résultats mesurables et que la trajectoire de mise sur le marché reste sous contrôle (figure 2).
Comment gérer un fonctionnement Medtech avec vos collaborateurs ?
Le second levier critique concerne la gestion des équipes de conception. Beaucoup de startups MedTech se reposent principalement sur des profils juniors, alternants ou stagiaires, encadrés par un CTO ou un ingénieur expérimenté dans le développement généraliste.
Ces profils sont dynamiques et peu coûteux, mais manquent de maîtrise des méthodologies d’ingénierie nécessaires dans un secteur où la traçabilité, la robustesse et la culture du livrable sont déterminantes.
Dans les projets complexes combinant hardware et software, les standards viennent d’industries comme l’aéronautique, l’automobile ou la défense, où l’on retrouve une gestion de projet rigoureuse, des outils de traçabilité, une culture du test et un suivi par livrables.
Pour réussir en MedTech, il est indispensable d’intégrer des collaborateurs ayant déjà pratiqué ce type d’approche. Un encadrement expérimenté permet non seulement de structurer le projet, mais aussi de faire monter en compétence les profils juniors.
Cette transition peut toutefois créer des tensions : certains collaborateurs n’adhèrent pas à cette discipline et quittent l’entreprise. C’est une étape normale dans la maturation d’une organisation. L’essentiel est de sécuriser les postes clés tel qu’un un chef de projet issu du dispositif médical, un responsable logiciel ayant déjà travaillé dans une industrie critique, et une organisation centrée sur la production de livrables traçables.
Le message aux équipes doit être clair : chaque activité technique doit produire un livrable traçable. Ces livrables constituent le premier indicateur de performance du projet et conditionnent l’accès au marché.
Mettre en place dès le départ un socle d’outils de traçabilité adaptés (ALM/PLM ou équivalents) permet de fiabiliser ce fonctionnement et de limiter les erreurs.
C’est le moyen le plus efficace d’aligner l’ingénierie et qualité autour d’un objectif commun : un produit conforme, industrialisable et prêt pour son marché.



Laisser un commentaire