Souvent perçu comme un simple texte a visée marketing, l’indication d’utilisation d’un dispositif médical à pourtant un rôle fondamental dans le coût et le délais de mise sur le marché. Sa définition et son évolution quand elle est bien pensée, peux permettre à votre société d’avoir dix coups d’avance sur vos concurrents, où à contrario, de leurs céder l’avantage.
A quoi correspond l’indication d’utilisation d’un dispositif médical ?
L’indication d’utilisation défini l’usage auquel est destiné votre dispositif médical.
En routine, il se trouve dans la notice. Il contraint l’usage et la promotion de votre produit, car c’est lui qui est approuvé par les autorités compétentes lors de la mise sur le marché.
Il peut être changé sur autorisation de l’organisme notifié ou l’autorité compétente.
Pour cela vous devez fournir des preuves de performances et de sécurité, via des études expérimentales solides.
Selon l’ampleur du changement, vous pouvez devoir déposer une nouvelle demande de mise sur le marché.
Ces contraintes sont critiques pour votre dispositif médical et son évolution et doivent donc être soigneusement réfléchies.
Quels sont les problèmes posés par une indication d’utilisation mal planifié ?
Les autorités sanitaires regardent une indication d’utilisation au travers d’un prisme. Elles décomposent cette dernière selon toutes ses variables.
Elles regardent ensuite les données quantitatives de performance et de sécurité pour chacune d’elle (Voir figure 1). Si ces dernières manquent pour une combinaison, votre mise sur le marché est bloquée.
Plus vous avez de combinaisons, plus vous devez produire de résultats.
Les coûts financiers explosent
Les délais aussi.

l’exemple du diagnostic du cancer du poumon.
Prenons un exemple fictif en restant sur la cancérologie. Un fabriquant décide de développer un logiciel de diagnostic in vitro visant à analyser des coupes histologiques de poumons pour identifier des cancers.
Comme vous pouvez le constater, l’indication d’utilisation est très simple, et c’est là tout le problème.

Il n’y a pas un type de cancer mais une cinquantaine. En ne spécifiant pas ces derniers, ce fabriquant sous-entends qu’il va détecter absolument tous les types et sous types de cancer des poumons. Sauf que :
Il y en a BEAUCOUP plus, la table ci-dessus vous montre sans ambiguïté l’étendue du problème.
Démontrer la performance de façon statistiquement robuste relève donc d’un défi colossal, surtout que certains d’entre eux ont des incidences très rares.
Au delà de l’aspect purement statistique, les autorités ont tendance à demander des données de performance sur le populations au sein de leurs propre pays. Dans un pays d’un milliard d’habitant il est possible d’avoir rapidement les données avec un échantillon statistique satisfaisant, mais ailleurs la tâche est plus ardue et chronophage.
Si ce fabriquant ne vient pas changer son approche, il est certain qu’il va se faire complètement bloquer par les autorités, et devra a la dernière minute réduire considérablement son champ d’application. Dans ce type de cas il se retrouve en porte à faux avec ses partenaires, clients et actionnaires car bien souvent ces derniers se sont vu promettre un diagnostique complète de tous les types de cancers des poumons en seulement 1 an.
Un sujet d’actualité dans l’industrie du dispositif médical
J’ai observé une situation type de ce que j’illustre dans cet article sur un marché de niche en Allemagne et Belgique. Trois startups y développaient chacune un dispositif médical de diagnostic in vitro.
Créées à un ou deux ans d’écart, elles ont lancé leurs produits avec des indications d’utilisation très larges. Cette stratégie risquée les a rapidement exposées à des rejets réglementaires en Europe et aux États-Unis.
Face aux autorités, elles ont dû abandonner plus de 90 % de leurs ambitions initiales et revoir profondément leurs objectifs. Elles ont ensuite consacré entre six mois et deux ans à produire des données cliniques pour des indications restreintes.
Une fois leurs dispositifs mis sur le marché, leur capacité à déployer de nouvelles fonctions s’est progressivement effondrée.
Près de dix ans plus tard, seule la société devenue leader a réellement innové, notamment en rachetant deux concurrents et leurs portefeuilles produits sur des indications autre que celles qu’elle souhaitait porter elle-même de base.
Malgré un marché porteur et financé, les deux autres n’ont produit aucune évolution significative sur leurs dispositifs médicaux. L’une d’elles a même réalisé un pivot stratégique complet, abandonnant le dispositif médical pour se concentrer sur des services destinés à l’écosystème.
Les milliards de capitaux ne sont pas une protection.
Il est difficile de blâmer les startups pour leur manque de capitaux, quand même IBM a échoué sur ce terrain.
Avec son supercalculateur Watson Health, IBM a tenté d’analyser 13 types de cancers en parallèle, au lieu de cibler moins. Cette stratégie trop large a provoqué d’énormes difficultés de démonstration clinique et de recrutement de patients ou praticiens médicaux. Malgré un chiffre d’affaires proche du milliard, IBM n’a pas atteint la rentabilité et a stoppé ce projet en 2022.
La vente des activités liées à l’analyse de données de santé a marqué la fin de cette initiative coûteuse.
Il est donc probable que vous soyez exposé au même risque, si vous ignorez votre niveau réel de vulnérabilité.
Vous devez d’abord comprendre votre exposition, puis définir une stratégie appropriée pour éviter ces échecs et dépasser vos concurrents.
Quel est le niveau de risque posé auquel vous êtes exposés ?
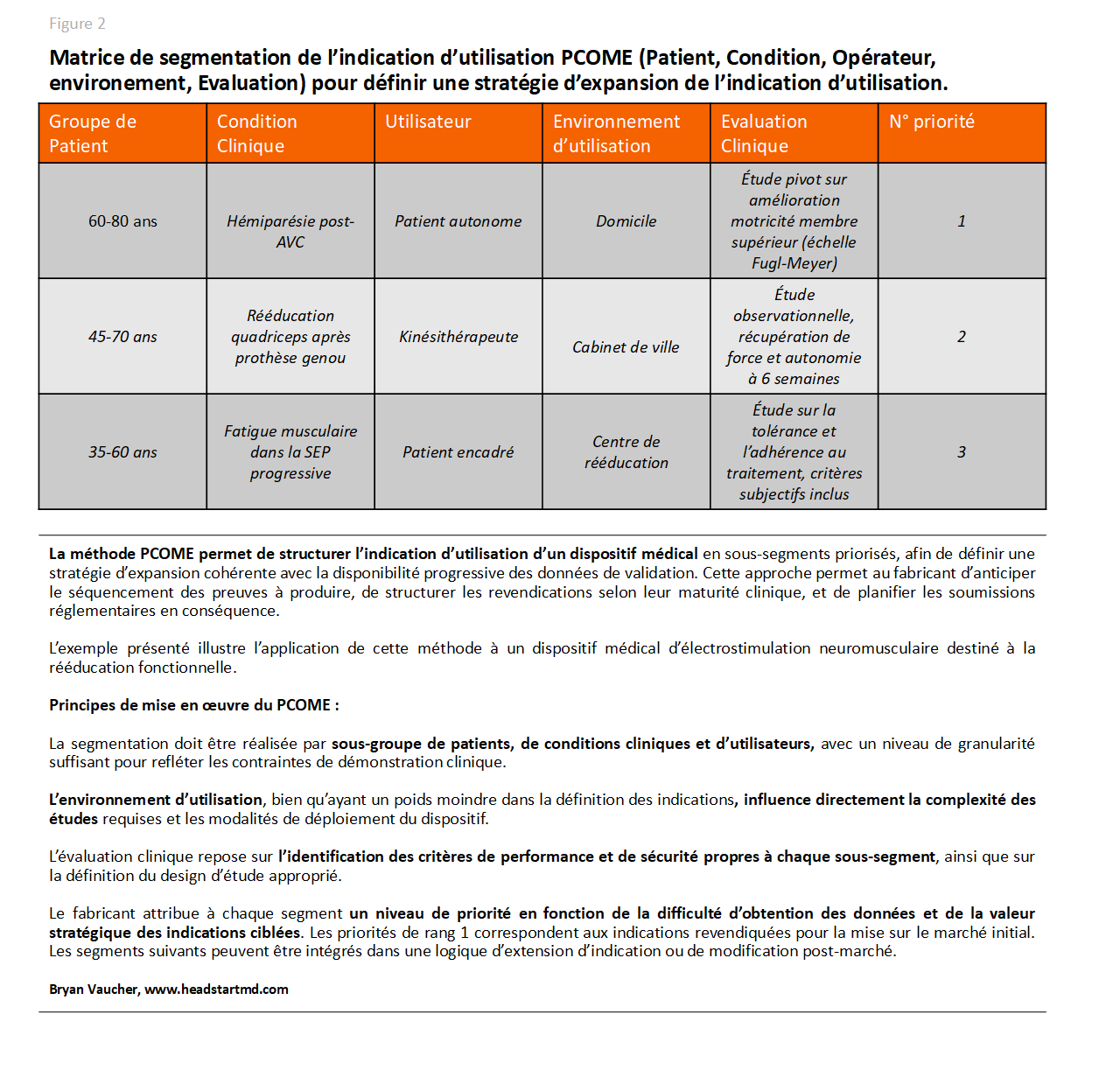
Faites une évaluation rapide de la charge clinique de votre dispositif médical avec la matrice PCOME
1.Segmentez l’indication d’utilisation
La première étape consiste à clarifier votre situation. Décrivez l’indication d’utilisation actuelle, qu’elle soit déjà formalisée ou implicite.
Adoptez ensuite la perspective d’un régulateur. Décomposez votre indication de manière systématique avec la matrice PCOME (Patient, Condition, Opérateur, Milieu/Environnement). Vous pouvez trouver un exemple en figure 2.
Cet outil simple permet de segmenter selon les conditions médicales, les sous-catégories, les groupes de patients et les utilisateurs concernés.
Il aide aussi à distinguer les contextes et environnements d’utilisation, pour obtenir une vision précise et opérationnelle de la réalité.
2.Identifiez les variables cliniques à quantifier.
Ajoutez une dimension supplémentaire correspondant aux critères de performance et de sécurité à démontrer pour chaque segment identifié.
Intégrez également la complexité des études nécessaires, qui varie selon le type de patients et le niveau de preuve attendu.
À ce stade doivent être pris en compte les aspects financiers et temporels. Chaque exigence implique des données, un coût et un délai.
L’analyse doit atteindre le niveau de détail le plus fin possible, afin d’éviter toute divergence d’interprétation entre les parties prenantes.
Pour chaque combinaison, précisez les métriques de performance, estimez la complexité des études, et vérifiez la disponibilité des patients ou données.
3.Priorisez vos segments
Cette méthode offre une vision claire des risques et des marges de manœuvre réellement disponibles dans le cadre réglementaire.
Dans la majorité des cas, il apparaît que l’ensemble des études prévues dépasse les délais ou budgets initialement annoncés.
Il devient alors nécessaire de repenser la stratégie, en hiérarchisant vos segments et en concentrant vos ressources sur les plus pertinents.
Définissez votre stratégie de mise sur le marché en cohérence avec votre indication d’utilisation
Maintenant que vous avez priorisés vos segments, vous devez redéfinir l’indication d’utilisation de votre dispositif médical, et ses évolutions futures. Il vous suffit de définir votre Minimal Viable Product, en partant des segments les plus critiques et pour lesquels vous avez le plus de facilité à prouver quantitativement vos performances avec un haut niveau de confiance statistique.
Initiez en parallèle les différentes études pour étendre le champ d’application de votre dispositif médical. Si vous fonctionnez au fil de l’eau et gérez convenablement votre organisation, vous pourrez déposer régulièrement des demandes de changement de votre produit et les faire approuver rapidement, sous réserve de ne pas complètement changer votre technologie, les risques associés, et de fournir des données de performance de bonne qualité.
Établissez une relation de confiance avec les autorités
La clé pour faire des changements rapides sans grande difficulté est d’agir avec beaucoup de transparence dans vos interactions avec les autorités compétentes et les organismes notifiés. Une relation de confiance va grandement fluidifier l’approbation de vos changements. A contrario, cachez des choses, soyez ambigus et passifs, et vous subirez un parcours du combattant à chaque changement.
Votre capacité à sortir rapidement de nouvelles fonctionnalités pour votre dispositif médical dépend intégralement de la rigueur de votre processus de conception et de la traçabilité associé. Si vos ingénieurs bloquent ou délèguent à des consultants ou d’autres départements comme la qualité, la rédaction des livrables de conception, vos chances de succès rapide sont proches de zéro. C’est pour cela qu’il est fondamental que vous transitionnez dès que possible d’une culture tech vers le mode de fonctionnement d’un fabriquant de dispositif médical.



Laisser un commentaire